CUADERNO VIRTUAL DE CIENCIAS NATURALES
martes, 29 de mayo de 2018
Semana 17
Esta semana el docente Jhon Alí Pérez nos llevo al laboratorio para experimentar con los tipos de separación de mezclas que consultamos posteriormente, los experimentos fueron los siguientes:




Cromatografía.
Este experimento consistió en ver como es que una sustancia puede alejar a otra estando a tan solo una pequeña distancia, claro pues lo hicimos a menor escala.
Lo que hicimos fue que con un pedazo de papel filtro y una gota de tinta en uno de sus extremos, lo sumergimos en una mezcla de alcohol-agua, pero de manera que no tocara la gota de tinta por ningún motivo.
El resultado fue que, al transcurso del tiempo, la gota de tinta se iba esparciendo al lado contrario dela mezcla alcohol-agua, cambiando sus colores y tonos con forme pasaba el tiempo hasta llegar hasta el tope, en pocas palabras la cromatografia consiste en separar una mezcla de otra mediante la repulsión de las 2 mezclas.
Filtración.
El experimento de la filtración, consistió en, con un embudo y un soporte universal, tomamos un papel filtro y formamos un cono para luego ubicarlo en el embudo, posterior a esto con una mezcla agua-arena procedimos a vaciarla en este embudo justo en el papel filtro, con un vaso de precipitado debajo del embudo, repetimos este procedimiento cada vez que el papel filtro se vaciara de esta mezcla.
El resultado fue agua limpia que quedó en el vaso de precipitado, no potable pero limpia de la arena y suciedad que tenía, entonces la filtración consiste en separar mezclas por medio de el filtro de una de ellas a través de un instrumento especial de filtración, dejando pasar la otra sustancia totalmente limpia.
Destilación.
El experimento de destilación consistió en calentar una mezcla de agua y sal en una media luna con un mechero de alcohol debajo de un soporte universal que sostenía la mezcla, íbamos a utilizar un tubo refrigerante pero debido a la negligencia de los estudiantes no se pudo utilizar para enfriar enfriar el vapor de agua.
El resultado fue sal pura en la media luna sin el agua, que por cierto se evaporo completamente dejando la sal, entonces la destilación consiste en separar mezclas por medio de la evaporación de una de las sustancias, se puede utilizar si ambas mezclas tienen distinto punto de ebullición, algo especial que tiene este método comparado a otros, es que este método deja completamente pura la sustancia que se evapora.
Otra cosa que realizamos fue una serie de mezclas o medidor de ph.
Mezclas de sustancias, medidor de PH.
Este experimento fue una serie mezclas y medidores de ph que realizamos con los materiales que el profesor dijo que trajéramos y con los que había de milagro en el laboratorio, primero picamos el repollo morado y lo masamos con alcohol hasta que el alcohol quedara totalmente morado y avinagrado, posterior a esto con unos tubos de ensayo vertimos una serie de sustancias, estas sustancias fueron: zumo de limón, ácido clorhídrico, sulfato ferroso, agua, alcohol avinagrado y bicarbonato de sodio en polvo.
Luego de esto procedimos a mezclar unos con otros.
El resultado de este experimento fue unos indicadores de ph, al mezclar sustancias unas con otras formaron distintas tonalidades de colores especiales que nos indican las bases, los ácidos y un medidor de ph casero.
Semana 16
Esta semana vimos acerca de las sales:

Existen 2 tipos de sales:
Para formar estas sales debemos tomar 2 elementos, el metal y el no metal, luego de esto escribimos primero el metal y posteriormente el no metal y cruzamos sus estados de oxidación, les agregamos agua y luego balanceamos la ecuación
HF + KOH -> KF + H2O
HCl + Na(OH) -> NaCl + H2O
Las Sales.
Una sal es un compuesto químico formado por cationes (iones con carga positiva) enlazados a aniones (iones con carga negativa) mediante un enlace iónico. Son el producto típico de una reacción química entre una base y un ácido, donde la base proporciona el catión, y el ácido el anión.Existen 2 tipos de sales:
Sales Haloideas.
Las sales haloideas son sustancias que resultan de la combinación de un hidróxido con un hidrácido.Para formar estas sales debemos tomar 2 elementos, el metal y el no metal, luego de esto escribimos primero el metal y posteriormente el no metal y cruzamos sus estados de oxidación, les agregamos agua y luego balanceamos la ecuación
HF + KOH -> KF + H2O
HCl + Na(OH) -> NaCl + H2O
Sales Oxisales.
Es el producto de sustituir alguno, o todos, los hidrógenos de un oxácido por cationes metálicos, por ejemplo K+, o no metálicos, por ejemplo NH4+.
Para formar estas sales debemos tomar el metal, el no metal y el oxígeno(con su coeficiente), los escribimos en el orden que dije, luego asignamos los coeficientes de la siguiente manera, el ion nometal oxígenom, vale todo -2, por lo que intercambiamos la valencia de ese ion con la de metal, si el ion -2 tiene otro coeficiente aparte del que ya tiene, lo encerramos entre paréntesis, luego balanceamos.
H2SO4 + F3(OH)3 -> H2O + Fe(SO4)3
Para nombrar estos compuestos, debemos tener en cuenta el estado de oxidación del metal únicamente, y dependiendo de el número de estados de oxidación y el estado de oxidación que utiliza, si tiene 2 estados de oxidación, "ato, ito" si son 3, "ato, ito, hipo-ito" si son 4, "per-ato, ato, ito, hipo-ito" así como en la nomenclatura tradicional.
Ejemplo:
LiBrO3: Bromato de litio.
Fe(BrO3)2: Bromato de hierro.
Semana 15
Esta semana vimos acerca de los acidos.

Para formar un Hidrácido es relativamente simple, lo que hacemos es escribir el oxígeno después de la flecha de produce y luego el elemento, más tarde se cambian los estados de oxidación de los elementos, luego balanceamos.
F2 + H2 -> 2HF
Cl2 + H2 -> 2HCl
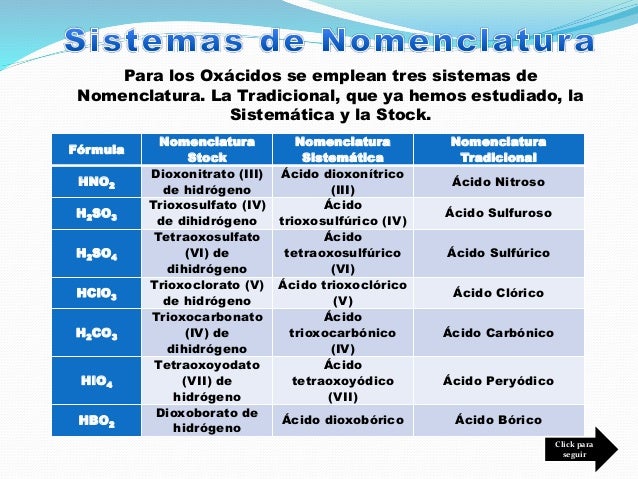
Los Ácidos.
Son aquellos compuestos vuelven el papel tornasol de color rojo, hay 2 tipos de ácidos, los hidrácidos y los oxácidos.

Los Hidrácidos.
Un ácido hidrácido , hidrácido o ácido binario es un compuesto binario ácido en el que el hidrógeno está unido a un no metal del grupo 7A (halógeno) o a un no metal, diferente del oxígeno.Para formar un Hidrácido es relativamente simple, lo que hacemos es escribir el oxígeno después de la flecha de produce y luego el elemento, más tarde se cambian los estados de oxidación de los elementos, luego balanceamos.
F2 + H2 -> 2HF
Cl2 + H2 -> 2HCl
Los Oxácidos.
Los oxácidos son compuestos ternarios formados por un óxido no metálico y una molécula de agua (H2O).
Para formar un oxácido lo que tenemos que hacer es escribir el hidrógeno, luego el elemento y el oxígeno después de la flecha de produce, luego asignaremos el coeficiente al hidrógeno dependiendo del grupo en el que se encuentre el elemento, así:
Grupo IIA: 2H
Grupo IIIA: 3H
Grupo IVA: 2H
Grupo VA: 3H
Grupo VIA: 2H
Grupo VIIA: 1H
N: 1H
De esta manera, y teniendo en cuenta la excepción que se presenta, es como asignamos los hidrógenos al oxácido, luego, sumamos este coeficiente con el estado de oxidación del elemento y lo dividimos entre 2, este resultado es el número de oxígenos que debemos colocar, luego balanceamos.
Ejemplo:
F2 + H2O -> HFO
SO + H2O -> H2SO2
Nomenclatura:
Para nombrar un hidrácido, lo único que tenemos que hacer es escribir "ácido" y posteriormente el nombre del elemento pero terminado en "hídrico" esta nomenclatura se debe a que estos compuestos no son muy numerosos, ejemplo:
H2S: Ácido Sulfhídrico.
H2Se: Ácido Selenhídrico.
Para nombrar un oxácido, se utiliza la nomenclatura tradicional, es simple, dependiendo de el estado de oxidación y el número de estados de oxidación del elemento, le damos el nombre, escribimos primero "óxido" y posteriormente el nombre de elemento y dependiendo de lo anteriormente dicho usamos los sufijos de la nomenclatura tradicional, ejemplo:
HFO: Ácido hipofluoroso.
H2SO2: Ácido hiposulfuroso

Semana 14
Esta semana Alí nos enseño como usar los sistemas de nomenclatura para nombrar compuestos.
Para nombrar compuestos, como los óxidos, existen 3 sistemas de nomenclatura:

Ejemplo:
K2O -> Óxido potásico.
F2O3 -> Óxido férrico.
FeO -> Óxido ferroso.


Para nombrar compuestos, como los óxidos, existen 3 sistemas de nomenclatura:
Nomenclatura Tradicional:
Para nombrar los compuestos por este sistema, tenemos que tener conocimiento sobre el estado de oxidación del elemento, en caso de los óxidos, el estado de oxidación del metal o no metal.

Lo segundo es escribir "óxido" al principio del nombre, posteriormente dependiendo de el estado de oxidación y el numero de estados de oxidación que tenga el elemento, damos el segundo nombre, si el elemento tiene 2 estados de oxidación, si se usa el mayor, terminará con "ico" al final del segundo nombre, de lo contrario será "oso", si tiene 3 estados, si se usa el mayor el segundo nombre será "ico", si se usa el del medio será "oso" y si es el de menor valor sera "hipo-oso" empezará con "hipo" y terminará con "oso", si son 4 estados, la de mayor valor será "per-ico", la de segundo mayor valor sera "ico", la de penúltimo valor sera "oso" y la de menor valor será "hipo-oso"
Lo segundo es escribir "óxido" al principio del nombre, posteriormente dependiendo de el estado de oxidación y el numero de estados de oxidación que tenga el elemento, damos el segundo nombre, si el elemento tiene 2 estados de oxidación, si se usa el mayor, terminará con "ico" al final del segundo nombre, de lo contrario será "oso", si tiene 3 estados, si se usa el mayor el segundo nombre será "ico", si se usa el del medio será "oso" y si es el de menor valor sera "hipo-oso" empezará con "hipo" y terminará con "oso", si son 4 estados, la de mayor valor será "per-ico", la de segundo mayor valor sera "ico", la de penúltimo valor sera "oso" y la de menor valor será "hipo-oso"

Ejemplo:
K2O -> Óxido potásico.
F2O3 -> Óxido férrico.
FeO -> Óxido ferroso.
Nomenclatura sistemática.
Para nombrar óxidos o compuestos por nomenclatura sistemática, solo tenemos que tener en cuenta los subíndices que usan los elementos químicos, dependiendo de cual sea el coeficiente, le pondremos los sgt nombres tanto al primer nombre como al segundo:
Ejemplo:
As2S3 -> Trisulfuro de diarsénico.
PF5 -> Pentafluoruro de fósforo.
Nomenclatura stock.
Para esta nomenclatura tenemos en cuenta el estado de oxidación del elemento, escribimos el nombre del elemento normal sin alteraciones y al final escribimos entre paréntesis y números romanos el el estado de oxidación de elemento.
Ejemplos:
Suscribirse a:
Comentarios (Atom)